弯道超车:2药品“出口转内销”,华海1品种视同通过一致性评价
日期:2018/6/8
近日,华海药业公告,其生产的缬沙坦片(规格:40mg,80mg,160mg)获得药监局药品注册批件。
首个出口转报国内获批,视同通过一致性评价
该品种是国内第一个“已在欧美上市但未在中国上市,使用境外数据申报、按照新4类仿制药审批视同通过一致性评价”的口服制剂,第一个出口转报品种获批的口服制剂,标志着口服制剂出口转报路径打通,对行业具有借鉴意义。
据华海药业公告称,缬沙坦片剂于2015年6月获得 FDA的新药简略申请批准。 2016年5月26日,华海药业就该药品首次向浙江省药监局提交注册申请并获得受理2016 年12月2日,国家药监局药品审评中心发布将缬沙坦片纳入优先审评药品注册程序并予以公示;
2018年6月1日,正式收到国家药监局核准并签发的缬沙坦片《药品注册批件》。历时3年时间,实现从境外申报转报国内获批的成功道路。
现缬沙坦片获得国家药监局的《药品注册批件》,标志着华海药业具备了在国内市场销售该药品的资格。
同时,根据国家相关政策,国内的药品生产企业已在欧盟、美国和日本获准上市的仿制药,可以根据国外注册申报的相关资料为基础,按照化学药品新注册分类申报药品上市,批准上市后视同通过一致性评价。
国内获批对华海经营业绩产生积极影响
通过一致性评价的药品品种,在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用。因此缬沙坦片作为公司共线申报的产品可视同通过一致性评价,有利于扩大产品的市场销售,提高市场竞争力,对公司的经营业绩产生积极的影响。
缬沙坦片主要用于治疗轻、中度原发性高血压。该药品由诺华制药研发,于 2001 年 7 月在美国批准上市。当前,缬沙坦片的美国主要生产厂商有 Solco Healthcare等,国内主要生产厂商有北京诺华制药有限公司、常州四药制药、鲁南贝特制药、华润赛科药业以及哈尔滨三联药业等。
据IMS数据库显示,2017 年,缬沙坦片美国市场销售额约 6100 万美元(约3.90亿元人民币),我国国内市场缬沙坦销售额较美国市场大,约 17.17 亿元。随着华海药业的缬沙坦片剂获批并视同获得一致性评价,相信会对市场产生不少的影响,对现实的产品厂家格局带来冲击。
按国办发〔2016〕8号文件的精神,通过一致性评价的药品品种,在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用。同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。
因此,华海的缬沙坦片进入市场后,有可能会利用视同通过一致性评价的政策,对当前存量市场进行抢夺。在一致性评价的背景下,率先通过者技术上的后发优势挑战存量市场的先发优势,弯道超车,这也是国家对通过一致性评价品种的一种鼓励。
无独有偶,普利制药注射用更昔洛韦钠走的也是类似的道路
注射用更昔洛韦钠注射液主要用于治疗免疫功能低下患者(包括艾滋病患者)发生的巨细胞病毒性视网膜炎,以及预防可能发生于有巨细胞病毒感染风险的器官移植受者的巨细胞病毒病。
注射用更昔洛韦钠 0.5g 是普利药业同步申报中国和欧盟注册的双报品种,已于 2014年2月获得荷兰上市许可、2014年4月获得德国上市许可、2016年2 月获得法国上市许可、2017年2月获得英国上市许可,并于2016年9月获得药品审评中心的优先审评审批资格。2018 年5月23日获得国家药监局颁发的药品注册批件。
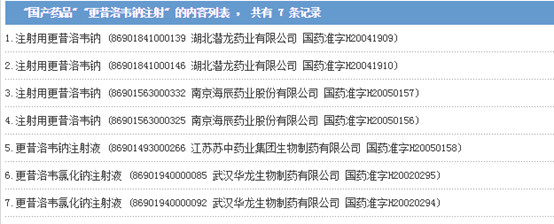
从国家药监局数据查询可知,目前我国获得注射用更昔洛韦钠批文的共有2个厂家,且均为本土企业,分别是湖北潜龙药业的“荷普欣”、南京海辰药业的“林可宏”;另有水针剂型---江苏苏中的“辉腾”,以及华龙生物的“迪都”(据中财网报道,更昔洛韦纳注射剂在国内市场规模为8 亿元左右)。
信息来源:医药云端工作室
|